

Некоторые бактерии живут в составе многоклеточных конгломератов, составленных из однотипных клеток (к настоящей многоклеточности это, впрочем, имеет мало отношения). Такие бактерии нуждаются в эффективных и адаптивных средствах защиты от своих главных врагов — вирусов. В недавней статье описан интересный способ, которым «многоклеточные» бактерии Thiohalocapsa sp. добиваются большой вариабельности в белках — сенсорах патогенов. Основу этой системы составляют особые ретротранспозоны, которые, внедряясь в гены-мишени, кодирующие сенсорные белки, привносят туда участки ДНК с повышенной частотой мутаций. Таким образом существенно повышается разнообразие таких белков в рамках колонии бактерий, а значит, увеличивается способность противостоять различным угрозам.
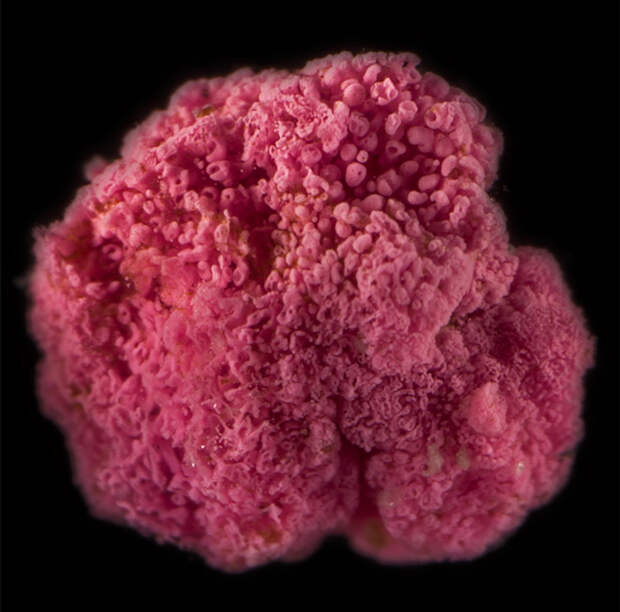
Иногда на североамериканских солончаках можно увидеть скопления небольших шариков розово-малинового цвета, напоминающих ягоды. Это колонии «многоклеточной» пурпурной серной бактерии Thiohalocapsa sp. (см. также Purple sulfur bacteria). Разумеется, «ягоды» тиогалокапсы не имеют никакого отношения к истинно многоклеточным организмам, поскольку клетки в них не делятся на функциональные типы, выполняющие специализированные задачи. Они состоят из однотипных бактериальных клеток, «склеенных» друг с другом за счет белков адгезии (см. Exopolymer). Мы для краткости будем называть тиогалокапсу «многоклеточной» бактерией.
«Ягоды» тиогалокапсы, как и скопления других «многоклеточных» бактерий, выглядят эффектно. Но для ученых они интересны не только и не столько этим. Жизнь в составе многоклеточного конгломерата, наряду с определенными выгодами, таит немало опасностей. В частности, такие бактерии особо уязвимы перед бактериофагами — вирусами, специализирующимися на заражении бактериальных клеток. В отсутствие эффективных защитных механизмов даже одна зараженная клетка может стать причиной гибели всей колонии: новые вирионы сразу же могут поражать новые клетки.
В ходе эволюции «многоклеточные» бактерии обзавелись защитой. В частности, в их геномах закодировано много белков-сенсоров антигенов, напоминающих аналогичные белки врожденной иммунной системы животных, причем наличие таких белков является прерогативой практически исключительно «многоклеточных» бактерий. Но в микромире, где идет постоянная эволюционная гонка вооружений между бактериями и вирусами, важно не только иметь защитную систему, но и уметь постоянно ее модифицировать, чтобы поспевать за своими «врагами». Другими словами, бактериям нужна вариабельность белков-сенсоров антигенов. В иммунной системе животных аналогичная вариабельность достигается путем рекомбинации в генах, кодирующих антитела и T-клеточные рецепторы, — в итоге на уровне популяции (как правило) обеспечивается достаточное разнообразие иммунной защиты.
В недавней статье, опубликованной в журнале PNAS, описан новый механизм, при помощи которого тиогалокапса, судя по всему, добивается повышения вариабельности своих белков.
Транспозоны — это мобильные элементы генома, то есть они могут менять свое положение и/или размножаться. Если не вдаваться в тонкости, есть две основные группы транспозонов. Транспозоны первой группы кодируют фермент транспозазу, который вырезает транспозон из генома и обеспечивает его вставку в новое место. Во вторую группу входят ретротранспозоны, при перемещении использующие обратную транскрипцию. Сначала ретротранспозон подвергается транскрипции как обычный элемент генома, а вот потом фермент обратная транскриптаза, как правило, кодируемая самим ретротранспозоном, синтезирует на матрице РНК, комплементарной исходному транспозону, ДНК-копию транспозона, которая может вставиться в другое место в геноме. Таким образом, ретротранспозоны не только перемещаются по геному, но и увеличивают свою копийность.
Естественно, транспозоны меняют нуклеотидную последовательность в месте своей вставки, поэтому они (в том числе и ретротранспозоны) сами по себе могут создавать некоторую вариабельность. Часто это стоит бактериальной клетке жизни из-за того, что транспозоны могут вставляться в жизненно важные гены и ломать их. Но иногда вставка транспозона оказывается весьма удачной и создает новый полезный вариант гена-мишени. Жизнь одной бактериальной клетки слишком коротка, чтобы в ней произошло несколько перемещений транспозонов. Гораздо более вероятный сценарий состоит в том, что накопление перемещений мобильных генетических элементов происходит клонально, то есть в поколениях потомков клетки некоторые транспозоны «прыгают» по геному.
Ретротранспозоны могут повышать вариабельность генов-мишеней еще одним способом: благодаря ошибкам в обратной транскрипции, возникающим из-за особенностей обслуживающей их обратной транскриптазы. На это способны не все ретротранспозоны: те из них, что могут увеличивать разнообразие генов, в которые они встраиваются, называются DGR (diversity-generating retroelement). DGR известны уже двадцать лет. Они были выявлены в геномах многих бактерий, архей и вирусов, но отсутствуют у эукариот.
Каждый DGR кодирует следующие элементы: склонную к ошибкам обратную транскриптазу, матрицу для обратной транскрипции, белок-мишень, содержащий область вариабельных повторов, а также некоторые вспомогательные белки. Работает вся эта сложная система следующим образом. Сначала синтезируется склонная к ошибкам обратная транскриптаза. В качестве матрицы для обратной транскрипции она использует матрицу особую матрицу-РНК с повторами, в которой на специфических позициях стоят адениновые нуклеотиды. Проводя синтез ДНК, обратная транскриптаза заменяет эти адениновые нуклеотиды на случайные (поэтому она и называется склонной к ошибкам). Затем ДНК, содержащая ряд точечных замен аденина на случайные нуклеотиды, встраивается в вариабельные участки генов-мишеней (рис. 3).
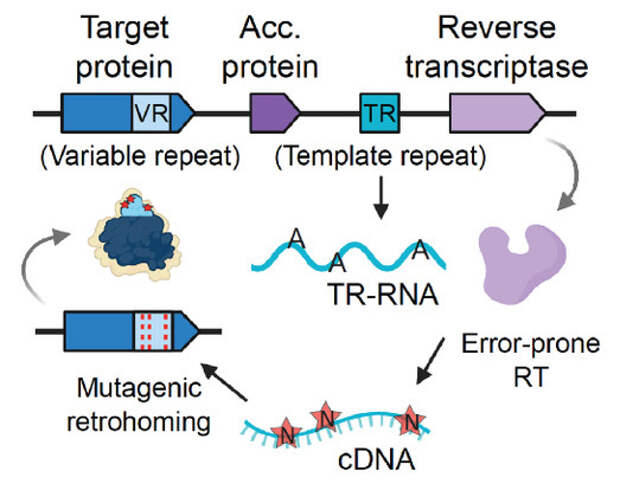
Вариабельный повтор лежит в основе уникальности белка-мишени. Когда склонная к ошибкам обратная транскриптаза вставляет случайные нуклеотиды в синтезируемую цепь ДНК, образуется гипервариабельная последовательность ДНК, содержащая повторы из исходной РНК-матрицы (см. Hypervariable region). Поскольку ее концы и концы гена мишени совпадают, происходит генетическая рекомбинация, и гипервариабельная последовательность попадает в ген-мишень, принося с собой и повторы. Что именно является геном-мишенью в этом случае — вопрос непростой. Функции генов-мишеней, разнообразие которых повышается с помощью DRG, в большинстве случаев могут быть выяснены лишь биоинформатически (путем сравнения с генами других организмов). Есть, впрочем, и исключения. Бактерия Bordetella с помощью DGR меняет рецепторы, взаимодействующие с фагами, а патогенные бактерии Legionella pneumophila и Treponema denticola с помощью DGR разнообразят липопротеины внешней мембраны, чтобы усложнить иммунной системе борьбу с ними.
В геноме тиогалокапсы были найдены 9 DGR и 15 генов-мишеней, кодирующих сенсоры антигенов. По оценке авторов, тиогалокапса теоретически может синтезировать 2×1045 вариантов одного белка-сенсора. А в пересчете на 15 генов-мишеней возможны 1,5×10294 вариантов белков-сенсоров. Конечно, такое астрономическое количество разных вариантов белков-сенсоров на практике никогда не реализуется.
DGR работают практически по одному и тому же механизму не только у тиогалокапсы, но и других «многоклеточных» бактерий. Связаны ли все они друг с другом эволюционно? Основываясь на аминокислотных последовательностях обратной транскриптазы в каждом DGR тиогалокапсы, авторы исследования показали, что все обратные транскриптазы тиогалокапсы принадлежат к одному из двух классов связанных с DGR обратных транскриптаз, которые встречаются у бактерий и архей, но не у бактериофагов. В целом, семь обратных транскриптаз тиогалокапсы, кодируемых DGR, близки к аналогичным белкам у эволюционно далеких «многоклеточных» бактерий. Детальный анализ показал, что в действительности DGR встраивались в геном тиогалокапсы не одномоментно, а за несколько раз, — по-видимому, они были позаимствованы от других бактерий при горизонтальном переносе генов.
Интересно, что DGR не только повышают разнообразие генов-мишеней: они и сами подвергаются мутациям, в частности, дупликациям и перемешиванию доменов. Эти дупликации повышают внутригеномный репертуар DGR, причем копии сами продолжают накапливать мутации, теперь уже независимо. Более того, в состав локусов DGR могут входить, помимо описанных выше функциональных транспозонов, «обломки» фермента транспозазы, а также тандемные повторы, оставшиеся от транспозонов группы IS-элементов, которые перемещаются по геному с помощью транспозазы. В общем, путей для получения огромного разнообразия генов, ассоциированных с защитой, у тиогалокапсы очень много. Но не может ли получиться так, что клетки в пределах одной «ягоды» начнут воевать друг с другом из-за вариаций в DGR? Как показали авторы исследования, в основе каждой «ягоды» стоит одна-единственная клетка, а все остальные клетки являются ее клональными копиями и идентичны по всем DGR, после одного. Ученые также показали, что существует связь между географическим местообитанием тиогалокапсы в разных регионах Северной Америки и геномным разнообразием, исследуя геномы «ягод», собранных в разных локациях. Важно отметить, что локация ограничивает разнообразие DGR, и репертуар может быть относительно стабильным в данном конкретном месте.
Авторы также попробовали детально разобраться в том, как устроены эти защитные белки на уровне функциональных частей — доменов. Оказалось, что у некоторых DGR белки-мишени содержали НТФазные домены семейства STAND (signal transduction ATPases with numerous domains), расщепляющие нуклеотиды. Эти домены играют важнейшую роль в работе врожденного иммунитета у растений и животных. Ранее было показано, что у бактерий белки, содержащие домен STAND, обеспечивают защиту против РНК-содержащих вирусов с геномом в виде одноцепочечной РНК, а также литических и лизогенных фагов, чей геном представлен двуцепочечной ДНК. Можно предположить, что эти противовирусные системы активны и у тиогалокапсы
Домен STAND содержит крайне вариабельный C-концевой участок, выступающий в роли сенсора, который связывает белки некоторых фагов и запускает программируемую клеточную гибель бактериальной клетки при участии N-концевого участка STAND. Вопрос программируемой клеточной гибели у бактерий, да и вообще многих одноклеточных организмов, весьма неоднозначный. Гибель клетки, никому ничем не обязанной, вряд ли как-то скажется на чем-то, кроме ее собственной судьбы. Другое дело — жизнь в многоклеточном агрегате: чтобы помочь клеткам, которые являются твоими клонами, можно и пожертвовать собой во имя общего блага. Возможно, STAND-домен как-то связан с программируемой клеточной гибелью у клеток тиогалокапсы в составе «ягод».
Еще одна составляющая защиты тиогалокапсы — домен CLec, который, по всей видимости, отвечает за распознавание инвазии фагов. У ряда DGR тиогалокапсы сенсорные белки содержат комбинацию доменов STAND и CLec в разном количестве. У одного DGR имеется особая защитная система, известная как VAMP (от Vesicle-associated membrane protein). В этой системе белок vWA в комбинации с CLec распознают вторжение и угрозу, активируют АТФазу MoxR, которая, в свою очередь, активирует белок VMAP. За счет этого в «ягоде», подвергшейся нападению, скажем, вирусов, запускается своеобразный иммунный ответ.
Обсуждаемая работа наглядно демонстрирует, что мы сильно недооцениваем возможности бактерий. Авторы осторожно предполагают, что «многоклеточные» бактерии могут обладать неким подобием врожденного иммунитета, но до уверенности в этом вопросе предстоит еще много исследований.
Источник: Hugo Doré, Amy R. Eisenberg, Emily N. Junkins, Gabriel E. Leventhal, Anakha Ganesh, Otto X. Cordero, Blair G. Paul, David L. Valentine, Michelle A. O’Malley, Elizabeth G. Wilbanks. Targeted hypermutation of putative antigen sensors in multicellular bacteria // PNAS. 2024. DOI: 10.1073/pnas.2316469121.
Елизавета Минина
Свежие комментарии