Ряд бактерий приспособлен к внутриклеточному паразитизму, но такой «высший пилотаж» как жизнь внутри ядра клетки, — большая редкость. Обычно ядерным паразитизмом промышляют бактерии-патогены протистов, однако в новой публикации в журнале Nature Microbiology описан такой случай у глубоководных морских моллюсков. Бактерии ‘Ca. Endonucleobacter’ живут в жабрах двустворок Bathymodiolus puteoserpentis и Gigantidas childressi, делятся в клеточном ядре, где достигают численности до 80 тысяч. Они вызывают «раздувание» органеллы — размеры ядра увеличиваются до 50 раз. Биологи выяснили, что в основе уникальных адаптаций эндонуклеобактера лежит горизонтальный перенос генов факторов-ингибиторов апоптоза (IAP) из генома моллюска-хозяина (возможно, опосредованный вирусами). Горизонтальный перенос генов от эукариот к бактериям считают редкостью, однако новая работа пополнила растущий список его примеров.
Паразитизм — явление, которое поражает своей универсальностью. Многие организмы научились получать одностороннюю выгоду от других существ, действуя на самые разные уровни их организации, — от целых популяций до отдельных клеток. Все «не вполне живые» вирусы — это исключительно внутриклеточные паразиты, жизненный цикл которых зачастую проходит в том числе в ядре. Нижним пределом масштабов паразитизма среди бактерий раньше считали жизнь внутри эукариотической клетки (таковы микоплазмы и микобактерии) или даже клетки других бактерий (Bdellovibrio bacteriovorus). Новым «прорывом» паразитизма в особо мелких размерах стало открытие бактерий, живущих внутри отдельных органелл, — это прежде всего ядерные паразиты протистов. Однако известны и бактерии, паразитирующие внутри митохондрий или эндоплазматического ретикулума (ЭПР, J. Verbeke et al., 2023. Host cell egress of Brucella abortus requires BNIP3L‐mediated mitophagy).
Многие живущие в морской воде животные содержат в себе гамма-протеобактерии из семейства Endozoicomonadaceae. Чаще всего они находятся в межклеточной среде, где ведут образ жизни паразитов или комменсалов, но некоторые представители семейства обитают внутри клеток.
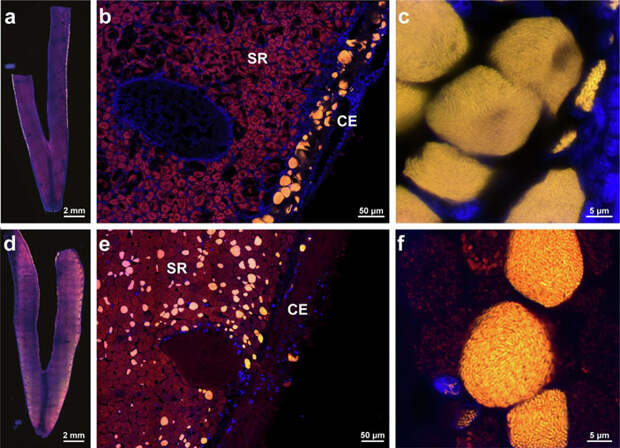
Первые Endozoicomonadaceae были извлечены из брюхоногих в 2007 году, за ними последовали бактерии из самых разных морских животных — от губок и кораллов до рыб. Все бактерии семейства, которые на сегодняшний день удалось культивировать в лаборатории (что далеко не всегда возможно), — это аэробные или факультативно анаэробные клетки с гетеротрофным питанием.О прокариотах-ядерных паразитах было известно ранее — они заражают главным образом протистов, но не животных (F. Husnik et al., 2021. Bacterial and archaeal symbioses with protists). Описана лишь одна клада Endozoicomonadaceae, к которой относятся ядерные паразиты, — это ‘Ca. Endonucleobacter’ (Ca. или Candidatus означает, что такие бактерии хорошо охарактеризованы, но пока не получены в виде лабораторной культуры). Эндонуклеобактер заражает ядра клеток живущих на большой глубине двустворчатых моллюсков семейства митилиды (рис. 1).
В новой работе ученых из США и Германии исследованы ткани двух видов моллюсков — Bathymodiolus puteoserpentis, выловленного из горячих вод гидротерм Срединно-Атлантического хребта, и Gigantidas childressi, живущего в условиях стабильно низких температур сипов (мест выхода газов) в Мексиканском заливе. Обычно клетки жабер таких двустворок содержат внутриклеточных симбионтов — автотрофные бактерии, обеспечивающие животных органикой, которую синтезируют за счет химических превращений. Авторы обсуждаемой статьи описали по одной новой паразитической внутриядерной бактерии из этих моллюсков с теми же видовыми эпитетами: ‘Ca. Endonucleobacter puteoserpentis’ и ‘Ca. Endonucleobacter childressi’, секвенировали их ДНК, собрали полные геномы, а также описали транскриптомы, протеомы и получили представление о метаболизме. Лазерная захватывающая микродиссекция, использованная вместе с высокоточным РНК-секвенированием для паразита и хозяина выявила их взаимодействие на разных стадиях инфекции. Локализацию ‘Ca. Endonucleobacter’ отслеживали с помощью флуоресцентной гибридизации in situ (FISH).
Ученые отметили, что ядерный паразит никогда не заражает клетки моллюсков, которые уже содержат симбиотические бактерии. Это справедливо для обоих рассмотренных видов двустворок, представляющих разные роды и отдаленные акватории, а также не зависит от типа симбионтов (G. childressi имеет только метанокисляющие бактерии, тогда как B. puteoserpentis — метан- и сероокисляющие). Более того, паттерн прослеживается в образцах тканей моллюсков одного вида, пойманных с разницей 13 лет. По-видимому, невозможность заражения паразитом эпителиальных клеток с симбионтами вызвана изменениями их поверхности — она лишена ресничек и микроворсинок, которые паразиты могут использовать для проникновения внутрь клеток.
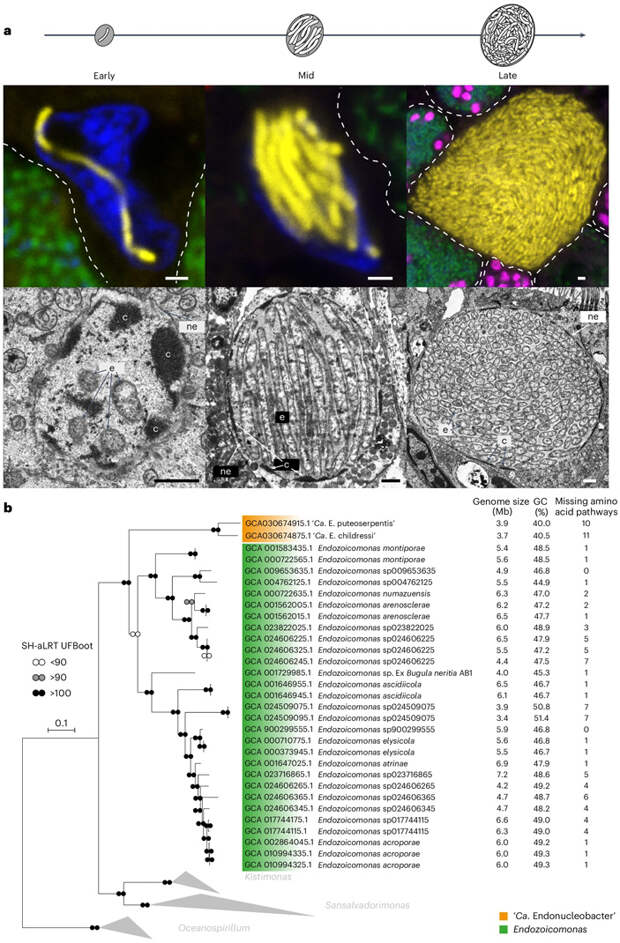
В то же время тканевое распределение паразитов в двух моллюсках сильно различалось (рис. 1). Жабры G. childressi содержали ядерных паразитов только во внешней несущей реснички части, тогда как в B. puteoserpentis бактерии были равномерно распределены по всем жаберным тканям. Геномы эндонуклеобактеров оказались сравнительно малы и имели низкое содержание GC-пар. Метагеномный анализ показал, что ДНК двух бактерий — ‘Ca. Endonucleobacter puteoserpentis’ и ‘Ca. Endonucleobacter childressi’ — имеют значительные различия, их геномы идентичны в среднем лишь на 84,3%. Филогенетический анализ с помощью 42 других геномов из баз данных выявил, что эндонуклеобактеры имеют монофилетическое происхождение, а их ближайшие родственники закономерно принадлежат к семейству Endozoicomonadaceae (рис. 2).
Оба описанных вида ‘Ca. Endonucleobacter’ имеют схожие метаболические пути, соответствующие бактериям с хемоорганотрофным типом питания. Их геномы содержат гены, необходимы для гликолиза, пентозофосфатного пути и цикла Кребса, а также кодирующие молекулы-переносчики углеводов (импортеры). А вот пути синтеза многих аминокислот (10 у ‘Ca. E. childressi’ и 11 у ‘Ca. E. puteoserpentis’) утрачены, что говорит о зависимости от чужих молекул при биосинтезе белка. Также ядерные паразиты имеют импортеры полипептидов (включая путресцин) и свободных аминокислот.
Анализ экспрессии генов в паре клеток «паразит — хозяин» в ходе развития инфекции выявил интересные закономерности. Оказалось, что бактерия экспрессирует многие импортеры для «ввоза» метаболитов извне на всех стадиях инфекции, но в конце жизненного цикла (перед разрывом клетки животного и выходом паразита наружу) делает это менее активно. Тем временем клетка-хозяин экспрессирует гены для импорта сахаров и аминокислот, а также для синтеза липидных капель на ранней и средней стадии заражения. Под конец инфекции ее метаболизм сильно нарушается и перестает производить питательные вещества, что заканчивается ее гибелью.
Обе изученные бактерии способны синтезировать хитиназу — фермент, который разрушает не только хитин, но и муцины. Эти крупные гликопротеины используются для питания за счет разрушения до сахаров паразитическими бактериями (например, Vibrio cholerae), причем именно благодаря наличию у них хитиназ. Полученные таким образом сахара затем импортируются в клетки моллюска, где разрушаются до N-ацетилглюкозамина ферментами, гены которых активны в ранней и средней фазах инфекции. Эта молекула может поступать в эндонуклеобактер за счет фосфотрансферазной системы бактерии. Предстоит выяснить, как ее хитиназа оказывает действие на муцин, который находится не в ядре и даже не в цитоплазме клетки-хозяина, а во внеклеточной среде.
Известно, что использующие ДНК бактерии (например, Vibrio cholerae или E. coli) экскретируют в окружающую среду (или свою периплазму) необходимые для этого ферменты-ДНКазы. Те разрушают нуклеиновую кислоту до олигонуклеотидов и отдельных оснований, которые бактерия затем переносит внутрь себя. Однако у ‘Ca. Endonucleobacter’ необходимые для такого питания компоненты отсутствуют или ограниченно активны. Например, ДНКазы этой бактерии лишены сигнальной последовательности, которая необходима для ее «экспорта» наружу. Выходит, фермент используется исключительно в рамках «домашнего хозяйства», то есть для разрушения собственных молекул ДНК бактерии. В пользу того, что эндонуклеобактер не специализируется на питании ДНК, говорит и состояние клетки-хозяина, — она сохраняет нормальную морфологию, высокий уровень метаболизма и экспрессию генов почти до самой гибели.
Другая непростая задача — понять, как ‘Ca. Endonucleobacter’ избегает иммунного ответа клетки животного, прежде всего — включения апоптоза. Ученые обнаружили в геноме бактерий гены ингибиторов апоптоза (по-английски inhibitors of apoptosis proteins, IAP). (Две системы бактериального «иммунитета» помогают друг другу бороться с вирусами, «Элементы», 28.04.2022) Кодируемые ими белки подавляют программируемую клеточную смерть, главным образом за счет связывания каспаз — протеазных ферментов, запускающих апоптоз у животных. У протистов в этом процессе каспазы обычно не задействованы. Впервые IAP нашли в заражающих насекомых бакуловирусах, затем эти эволюционно консервативные белки обнаружили также у всех эукариот. Однако наличие IAP у бактерий довольно неожиданно и предполагает, что они скорее всего были у кого-то позаимствованы. У ‘Ca. E. childressi’ оказалось семь генов ингибиторов апоптоза, а у ‘Ca. E. puteoserpentis’ — целых 13 (рис. 3). При этом на ранней стадии инфекции первая бактерия экспрессирует три IAP, на средней — шесть, а на поздней — уже все имеющиеся семь генов.
Апоптоз эукариотической клетки обычно запускают нарушения метаболизма, повреждения ДНК или связанный с эндоплазматическим ретикулумом стресс. Авторы выяснили, что клетки моллюска G. childressi ожидаемо запускают механизмы апоптоза в ответ на грубое вмешательство эндонуклеобактера, что бактерия парирует выделением ингибиторов апоптоза. Ученые называют такую «борьбу» между хозяином и паразитом за управление метаболизмом гонкой вооружений. Похожая борьба ведется человеком с инфекциями и опухолями при помощи антибиотиков и ингибиторов факторов роста соответственно.
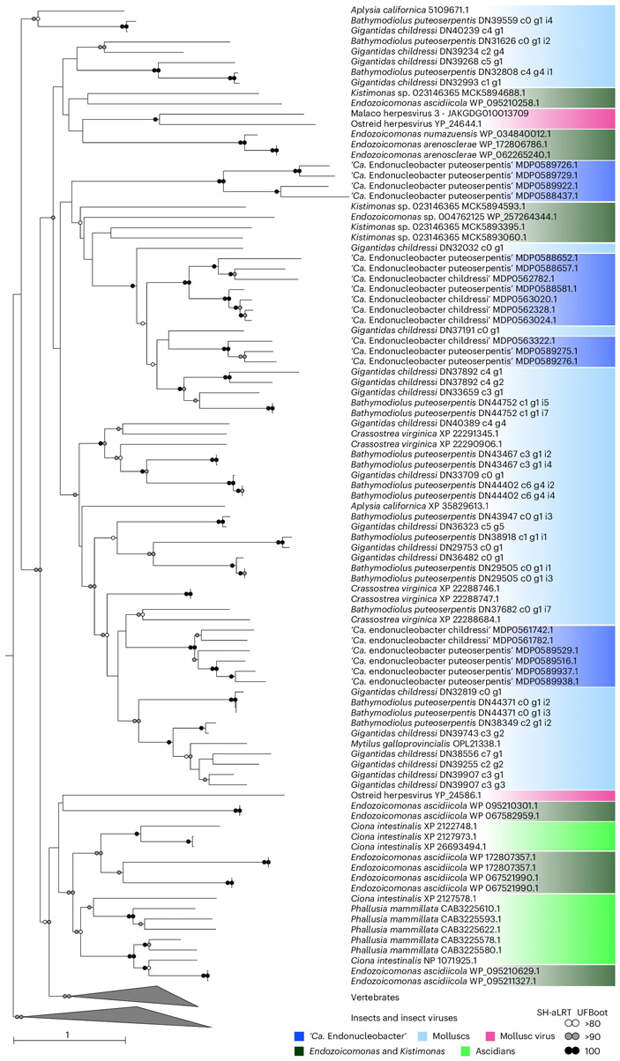
Остается вопрос, как живущая внутри ядра бактерия получила совершенно нехарактерные для нее IAP? Поиск в геномах других патогенов морских животных показал, что гомологичные гены (помимо двух бактерий ‘Ca. Endonucleobacter’) имеют четыре бактерии из рода Endozoicomonas и одна из рода Kistimonas. Изученные последовательности IAP скорее всего не происходят от единого предка, а представляют девять отдельных клад. Среди них у вновь описанных бактерий имеются три — нетрудно догадаться, что они сильнее всего похожи на ингибиторы апоптоза из геномов их моллюсков-хозяев. Также им близки гены IAP из вируса герпеса устриц OsHV-1, по-видимому, заражающего и двустворок, на которых паразитирует эндонуклеобактер. Очевидно, произошел горизонтальный перенос генов между животными, их вирусами и бактериями-паразитами. Поскольку IAP функционируют только у животных, именно они стали донорами генов, причем в бактерии те могли попасть опосредованно через вирусные геномы. Передачу генов от эукариот к бактериям считают экзотическим явлением (в отличие от обратного переноса), поскольку ей мешает наличие в эукариотических геномах интронов и сравнительное однообразие их метаболизма. Однако новые данные — в том числе обсуждаемая статья — дают понять, что горизонтальный перенос генов от ядерных клеток к прокариотам может встречаться шире и иметь большее эволюционное значение, чем принято считать.
Источник: Miguel Ángel González Porras, Adrien Assié, Målin Tietjen, Marlene Violette, Manuel Kleiner, Harald Gruber-Vodicka, Nicole Dubilier & Nikolaus Leisch. An intranuclear bacterial parasite of deep-sea mussels expresses apoptosis inhibitors acquired from its host // Nature Microbiology. 2024. DOI: 10.1038/s41564-024-01808-5.
Михаил Орлов



Свежие комментарии