Вы наверняка слышали про CRISPR-Cas9 – технологию, за которую недавно дали Нобелевскую премию. Её используют, чтобы производить природное биотопливо, создавать злаки, устойчивые к вредителям, и даже светящиеся цветы. С ее помощью изменяют сердца и почки свиней, чтобы они приживались в человеческом теле, лечат наследственные заболевания.
Учёный Хэ Цзянькуй благодаря CRISPR-Cas9 тайно модифицировал ген CCR5 в двух зародышах – и на свет появились девочки-близняшки с предполагаемой устойчивостью к ВИЧ. За это биолога приговорили к трём годам заключения – сейчас мужчина уже на свободе и продолжает заниматься научной деятельностью. Сегодня я расскажу все, что нужно знать об этой удивительной технологии генной инженерии. И как она меняет нашу жизнь.Искусственные органы
Вы наверняка слышали о пациентах, которым пересаживали свиные сердца, и пациенте, которому пересади свиную почку. Свиные органы хорошо подходят нам по размеру. Но свиньи не близки людям генетически, поэтому человеческое тело агрессивно отторгает их ткани. Межвидовая пересадка стала возможной только благодаря генной инженерии.
Чтобы сделать сердце или почку свиньи более совместимой с нами, в геном свиньи вносят множество изменений. Для сердца было сделано 10 генетических правок, а для последней версии почек аж 69. Среди этих изменений были правки, которые улучшают работу самого органа, усиливают его кровоснабжение сосудами, повышают выживаемость, снижают риск иммунного ответа. А еще в одной работе внесли 62 модификации только для того, чтобы обезвредить некоторые спящие вирусы, пассивно встроенные в ДНК свиней и потенциально опасные для человека.
К сожалению, все три пациента со свиными органами умерли спустя 1,5-2 месяца после пересадки. Возможно, дело в том, что пациенты изначально были максимально нездоровы. Но, что примечательно, никаких признаков отторжения органов не было. Это подтверждается экспериментами на здоровых обезьянах. Некоторые из них прожили с органами ГМ-свиньи больше года.
Все эти модификации свиней – дорого и непросто. Зато, если вы однажды создали такую ГМ-свинью, то дальше ее можно культивировать обычным способом. У её потомков тоже будут подходящие для человека органы.
Сельское хозяйство
CRISPR-Cas9 может помочь и в сельском хозяйстве. Возьмем для примера рис. С помощью CRISPR-Cas9 учёные создали рис, устойчивый к холодам, рис, который лучше растет в засоленной почве, рис с более длинными и крупными зернышками, рис, богатый антиоксидантом – антоцианином. И каждое из этих улучшений становится врожденным генетическим свойством риса, которое сохранится навсегда. В большинстве улучшений ничего чужого в рис не добавляли, а лишь выбивали какой-то ген, или наоборот, усиливали его активность. Впрочем, и во внедрении чужих генов ничего априори плохого нет. Мифы о ГМО я подробно разбирал в книге Сумма Биотехнологии.
Ещё CRISPR-Cas9 поможет перейти на биотопливо в наших машинах и генераторах. Мы уже научились делать топливо для машин из кукурузы, сахарного тростника, сои и т.д. Сейчас вся Америка ездит на бензине с 10% добавкой биоспирта, а то и больше. В Бразилии бензин без 25% спирта даже не продают. А можно ездить и на чистом спирте из кукурузы или тростника. И хотя это неидеально с точки зрения износа моторов, зато такое горение чище, а само топливо возобновляемо. Но оно все еще недостаточно дешево, чтобы вытеснить нефть.
А благодаря CRISPR-Cas9 ситуация может измениться. Например, можно модифицировать бактерии и дрожжи, чтобы те производили биотопливо более эффективно. Причем не только из пищевого сырья, но даже из опилок и бумаги. Есть целый набор возможных генетических улучшений – во-первых, можно отредактировать геномы микроорганизмов, чтобы они производили меньше ненужных веществ. В результате очищать топливо проще – и нет примесей, которые снижают его качество или загрязняют окружающую среду. Кроме того, при работе с древесно-целлюлозными отходами в биомассу для производства топлива добавляют ферменты для расщепления древесины. А тут можно добавить гены этих ферментов прямо в нужные нам микроорганизмы. Наконец, целлюлоза лучше ферментируется при высокой температуре. Значит, сделаем так, чтобы наши микробы были более устойчивы к жаре. И ещё – часть биотоплива делают из микроводорослей. С помощью генной инженерии можно усилить эффективность их фотосинтеза, чтобы они лучше захватывали CO2 из воздуха.
Все организмы должны копировать свою ДНК и тратить на это энергию. Для нашего тела это маленькая статья расходов, а вот для микроорганизма огромная. Что ж, берем и уменьшаем ДНК бактерии до предела, вырезая все ненужные гены: теперь на размножение тратится куда меньше энергии. И все больше ресурсов идет на выработку топлива. Например, ученый Крейг Вентер создал микоплазму лабораторную, у которой почти вдвое меньше генов, чем у обычной микоплазмы. Такие организмы могут стать идеальными производителями топлива.
Светящиеся дрова и мясо
Меня очень впечатлила статья 2023 года «Создание биолюминесцентных лесов с помощью CRISPR-CaS9». Кстати, такие леса предложил делать старшеклассник из Индии – чтобы гулять по ночам без страха и использовать ветки в декоре. А в 2024 году в США открыли предзаказ на светящееся домашнее растение в горшке, «Светлячковая петуния», разработанное вместе с российскими учеными. Всего 30 долларов! К сожалению, всю рассаду уже раскупили.
Польза от светящихся белков – не только в красоте. С помощью такого свечения можно распознавать болезни и даже нелегальные примеси в продуктах. Для этого ученые модифицировали сам инструмент для генной модификации, Cas9. Приделали к ножницам для ДНК половинки светящегося белка из глубоководных креветок, а сами ножницы притупили. Теперь, если ножницы находят нужную мишень, а точнее, две мишени, расположенные рядом, то приземляются на них, из двух половинок белка получается целый, и вуаля – оно светится.
Получается детектор конкретных последовательностей ДНК. Вот есть у вас в слюне, например, коронавирус. Плюнули в пробирку, а она начинает светиться. Значит, заболели. Или, допустим, вы Павел Дуров – и вам нужно найти своих детей. Плюет ребенок в пробирку со специальным детектором. Засветилась нужным цветом? Ваш! И пусть не говорят, что на детей плевать!
Генные терапии
В 2023 году FDA одобрило генную терапию с использованием CRISPR-Cas9 против серповидно-клеточной анемии. Это тяжелая болезнь, когда красные кровяные тельца имеют неправильную форму. Как работает терапия? У пациента забирают стволовые клетки из костного мозга. Редактируют гены этих стволовых клеток, чтобы они производили правильные эритроциты – и возвращают их в организм. Учёные исследуют генетические терапии и для других болезней, от бокового амиотрофического склероза до синдрома DIDMOAD, от которого слепнут и глохнут дети.
Тайны древней технологии
Есть такая бактерия — Streptococcus thermophylus. Ее широко используют в молочной индустрии. Именно благодаря ей мы едим моцареллу и йогурт. Ее также используют в закваске для пармезана, эмменталя, грюйера. В одном только 1998 году с помощью этой бактерии в США произвели 600 с лишним тыс. тонн йогурта и больше млн тонн моцареллы. Но есть у этой бактерии одна проблема. Дело в том, что бактерии болеют. Их заражают особые вирусы, бактериофаги. Поэтому ученые пытались повысить устойчивость полезных бактерий к инфекциям. Но в какой-то момент обнаружили, что у них уже есть эта функция. И она очень хитро работает. Внутри многих бактерий есть специальные белки-ножницы, которые распознают и вырезают кусочек ДНК вируса – и засовывают его в собственную ДНК бактерии.
Бактерии – опытные генные инженеры. Некоторые из них любят редактировать геномы растений и так заставляют их производить питательные вещества для себя. Но и самих себя они генномодифицируют не менее охотно. Подъедают кусочки ДНК из окружающей среды, а еще обмениваются генетическим материалом друг с другом с помощью кольцевых молекул ДНК, которые называются плазмидами. С помощью плазмид они могут, например, делиться с товарищами устойчивостью к антибиотикам. Ну и от вирусов бактерии получают генетические фрагменты. Умение целенаправленно встраивать в себя фрагменты вирусов есть у большинства известных видов бактерий и архей, а ведь это две самые древние формы жизни. Получается, генная инженерия — это древняя технология предков.
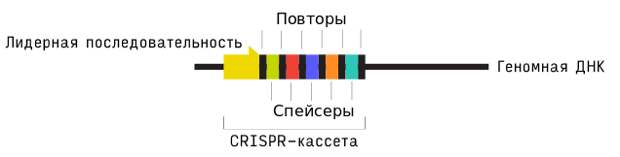
А теперь расскажу, как учёные изобрели генетические ножницы. Обычно в новостях пишут «CRISPR-CaS9». Но на самом деле это две отдельные вещи. CaS9 — это белок, который режет ДНК. А CRISPR — особые участки ДНК у бактерий и архей. Они похожи на базу данных компьютерного антивируса, в которой хранятся фрагменты ДНК бактериофагов. Эта база данных может пополняться фрагментами генетического материала новых вирусов, с которыми клетка встречается. База данных наводит ножницы на цель.
В 2005 году сразу несколько ученых сравнили ДНК вирусов с кусочками ДНК в необычной CRISPR-структуре и обнаружили, что уникальные кусочки ДНК, обрамленные повторяющимися участками, очень похожи на чужеродные гены. На гены вирусов, которые бактерия интегрирует в свою ДНК.
И в дело вступили йогуртологи из корпорации Danisco. В 2007 году они показали, что CRISPR-система представляет бактериям противовирусную защиту. Я хорошо помню, как тогда разгорался ажиотаж вокруг этого открытия. Когда я готовился сдавать диплом в МГУ, моя научная руководительница активно изучала CRISPR и все уши мне прожужжала, насколько это важно. Евгений Кунин, один из самых цитируемых биологов в мире, пророчил «крисперу» великое будущее. Кунин действительно стоял у истоков этого открытия. О том, что CRISPR нужен не для ремонта ДНК, а именно для защиты от вирусов, он с коллегами писал еще в 2006 году.
Но оставался вопрос: а что с этим открытием делать? Да, бактерии борются с вирусами, а нам-то что с того? На этот вопрос ответили в 2012 году американка Дженнифер Дудна и француженка Эммануэль-Мари Шарпентье. Они опубликовали статью в Science, где раскрыли все устройство механизма с начала и до конца – и научились «программировать» молекулярные ножницы так, чтобы те разрезали ДНК точно там, где мы захотим.
Библиотекари-убийцы
И это великое открытие Дудна с Шарпентье получили Нобелевскую премию. Причем всего через 8 лет, в 2020 году. Обычно Нобелевский комитет ждет, пока открытие покажет себя на все 100%. Но тут масштаб прорыва был очевиден.
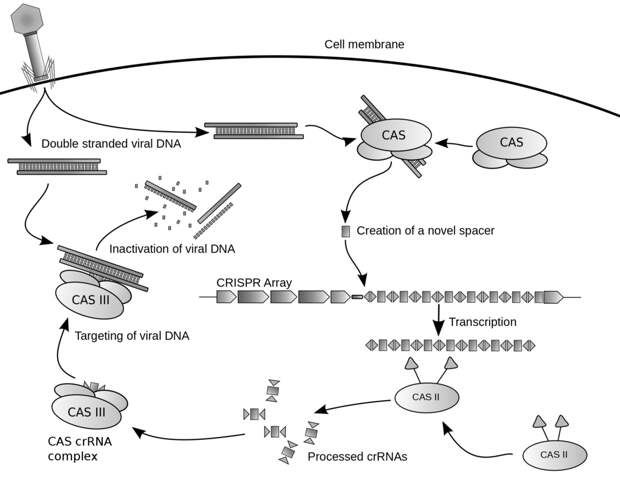
А сейчас посмотрите на картинку.
Вверху вы видите вирус-бактериофаг, который проникает через мембрану клетки бактерии. У вируса есть ДНК! Специальные белки Cas, — но не Cas9, а другие, — вырезают фрагменты этой ДНК. И вставляют в особое место в ДНК самой бактерии, в ту самую CRISPR-кассету. Как мы добавляем новую запись в базу данных антивируса. С этой ДНК считывается большое количество одноцепочечных молекул РНК, своими частями подобные различным вирусам.
Затем большая РНК, где есть фрагменты множества вирусов, нарезается на маленькие кусочки, как раз по разметке. Теперь в каждом кусочке лежит образец всего лишь одного вируса – как листовки «разыскивается преступник». А дальше, как полицейский по приметам ищет преступника, так и белок Cas9 берет эти «РНК-листовки» и ищет полноразмерные вирусные частицы, которые похожи по описанию. Разрезает их – и вирусы гибнут.
Как обмануть клетку
Эти РНК-листовки, которые использует белок Cas9 для охоты на вирусов, называются «направляющие РНК». Именно они говорят молекулярным ножницам, что делать. Но что, если подсунуть белку Cas9 придуманную нами «направляющую РНК»? Мы можем натравить его на любую генетическую последовательность. Можно даже вырезать ВИЧ, который коварно встроился в ДНК клеток.
Причем еще в 2013 году ученые смогли показать, что такую упрощенную систему из направляющей РНК и белка Cas9 можно запихнуть в любую клетку, в том числе человеческую. И запустить процесс направленного генетического редактирования. Достаточно ввести в клетку два гена. Один кодирует ножницы Cas9, другой – направляющую РНК. И они тут же принимаются за совместную работу.
Почему чужие гены вдруг начнут работать внутри моей клетки? Дело в том, что каждая ДНК состоит из одних и тех же четырех нуклеотидов. Что у меня, что у вас, что у бактерии. Поэтому сами по себе гены одних организмов и других довольно совместимы. Считайте, что у нас одна операционная система. И иногда достаточно ввести кусочки ДНК в ядро клетки, чтобы новые гены заработали.
Вирусы тоже проникают внутрь клетки и начинают нагло использовать ее генетические фабрики, заставляют ее синтезировать свои копии. При использовании CRISPR-Cas9 мы делаем то же самое, но обращаем это оружие на пользу человеку. Ну а ввести гены внутрь клетки можно по-разному. Иглой, с помощью вируса, в форме плазмиды или как-то еще.
Как зашить хромосому обратно?
Расскажу про страшную штуку, которую придумали ученые. Называется она «мутагенная цепная реакция». Мутагенная цепная реакция — это один из методов применения CRISPR-Cas9, описанный в Science. Он позволяет отменить классические законы наследственности. Сделать так, чтобы генетический вариант передавался не половине потомков, как обычно, а всем.
Вот обычно как происходит? У меня каждая хромосома в двух экземплярах, одна копия от мамы, а другая от папы. И каждому гипотетическому ребенку я передам только одну хромосому из каждой пары. Если на какой-то хромосоме у меня уникальная мутация, то передастся она половине моих детей. А мутагенная цепная реакция все это берет и отменяет.
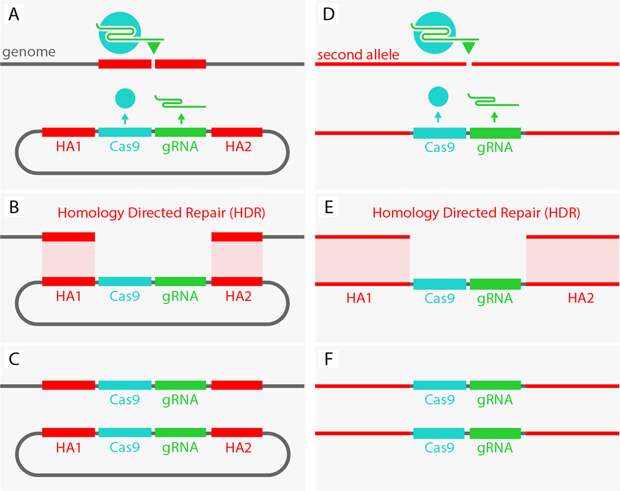
Вот картинка из статьи.
Смотрим на картинку А. Вверху естественная ДНК мушки дрозофилы в мушиной клетке. Внизу – созданная учеными петля из ДНК, на которой спрятаны гены белка Cas9 и направляющей РНК, которая говорит, где будем резать. Красным отмечена зона вокруг предполагаемого места разреза. Это место, которое узнает и разрезает белок Cas9. А участки HA1 и HA2 очень похожи на места слева и справа от разреза.
Теперь представьте, что мы разрезали ДНК в указанном месте. Что делает клетка? Пытается сшить разрыв обратно. Но тогда «ножницы» снова узнают свою мишень и делают разрез. Клетка сшивает, ножницы разрезают. Сшивает. Разрезают. Как война правок на страничках в Википедии.
К счастью, у клетки есть другой способ ремонта. Если ей «покажется», что из разрыва могли потеряться несколько генетических «предложений», она пытается «подсмотреть» недостающий текст во второй копии ДНК, которая где-то рядом. Недаром же у нас двойной набор хромосом! Но вторая копия хромосомы в этом месте точно такая же. Ее тоже разрезают и сшивают по кругу. Что же делать несчастной клетке? Тут мы и подсовываем ей единственный выход из этого бесконечного цикла. Мы не просто так сделали нашу искусственную кольцевую ДНК с участками Ha1 и Ha2, похожими на предполагаемое место разреза. Из-за этого сходства, клетка может решить, что наша конструкция и есть резервная копия. Левый конец похож? Похож. Правый конец похож? Ладно, вставляем весь кусок между концами, как будто так и надо. Победа. Получилась картинка C. Мы добились своей цели, разрезание ДНК останавливается. Ведь красные кончики теперь далеко друг от друга, и ножницы больше не находят мишень.
Теперь гены ножниц Cas9 и направляющей РНК встроены внутрь хромосомы, вместе со вставкой. Получается, мы с помощью генной инженерии наделили клетку наследуемым инструментом для генной модификации. И когда такая мутантная хромосома передастся потомку, она модифицирует по своему образу вторую копию этой хромосомы, доставшуюся от другого родителя. На этих рисунках две линии — это уже две хромосомы. Едва отредактированная хромосома оказывается в одной клетке с другой, где такой вставки нет, — ножницы тут же включаются, и снова происходит якобы ремонт ДНК. Отсюда и название «мутагенная цепная реакция». Она гарантирует, что у всех ваших потомков и их потомков – и потомков потомков потомков – будет эта мутация.
Безопасный вариант
Многие в свое время испугались этой технологии со страшным названием. Что, если мутация вредная? Или со временем вставка сломается и станет вредной? Хорошая и одновременно плохая новость в том, что если смена поколений у вида медленная, то и сделать что-то во благо или во вред с помощью мутагенной цепной реакции не получится. Замучаетесь ждать, пока мутация распространится. Зато теперь я могу описать, как устроен реально рабочий и гораздо более контролируемый метод CRISPR-Cas9. Метод, который позволяет вставить новый участок в геном, в строго нужное нам место, но без лишних последствий.
Возьмем еще раз конструкцию, как на картинке А. Но при этом не будем вставлять гены ножниц внутрь вставки, между HA1 и HA2. Поставим эти гены снаружи. Тогда ножницы сработают лишь один раз. А во вставленном куске будет только полезная нагрузка. Например, ген для того, чтобы организм самостоятельно синтезировал витамин С, способность, которую мы утратили. Тогда цепной реакции не будет. Наследуемость у этой мутации будет такая же, как с любым геном в природе.
Но есть класс задач, для которых демона мутагенной цепной реакции можно использовать прицельно. Как своего рода биологическое оружие, которым вы можете навсегда изменить целую популяцию. Например, ненавистный для многих борщевик Сосновского. Это инвазивный сорняк, который разрушает экосистемы и опасен для людей. Вставляем в борщевик мутагенную бомбу со встроенными ножницами. Она делает борщевик уязвимым к некому веществу, которое для других растений безвредно и которое обычно борщевику не встречается. Далее выпускаем наш мутантный борщевик в природу и массово опыляем его пыльцой другие борщевики. Из-за того, что наша мутация передается абсолютно всем потомкам, спустя некоторое время она становится доминирующей. Заражение ширится в геометрической прогрессии. Через 30 лет большая часть борщевиков имеет эту мутацию. Наступает «час икс», и мы изничтожаем ничего не подозревающие борщевики одним сокрушительным ударом – вирусом или веществом.
Это чистая гипотеза. Но это возможно.
Чтобы понять, чем так понравился CRISPR-Cas9 учёным, нужно сделать шаг назад в историю. Ведь гены редактировали задолго до этой технологии. Например, в 1972 ученые впервые соединили фрагменты ДНК двух вирусов – и получили так называемую рекомбинантную молекулу ДНК. В 1974 году вывели первую ГМО-мышь. А сам факт, что ДНК можно разрезать и склеивать обратно, доказали даже раньше, в конце 1960-х. Затем был бум генной инженерии растений. Технологию мы подсмотрели у бактерий. Так, в 1983 году американские ученые генномодифицировали табак, сделав его устойчивым к антибиотикам. В 1992 году в Китае создали первое коммерческое растение табака, устойчивое к вирусам. А в 1994 году вышел на рынок первый съедобный ГМО-помидор с более длинным сроком хранения.
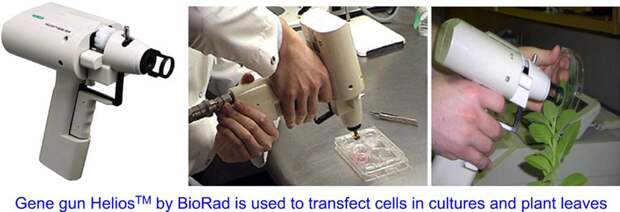
Что же нового тогда нам дали генетические ножницы? Повышенную точность и безопасность. Теперь мы выбираем, где именно мы хотим что-то отредактировать. Объясню на примере тех же растений. До «криспера» их гены модифицировали преимущественно двумя способами. Первый — это генная пушка. Берем кусочки ДНК, помещаем их на мельчайшие наночастички вольфрама или золота, то есть биологически инертных металлов. А потом буквально заряжаем ими воздушную пушку и выстреливаем ими в специально подготовленную растительную ткань. Стреляем наудачу, как из дробовика. Частички застревают кто где, какая-то да попадет в нужную часть ядра. В большинстве случаев ничего не выходит. И лишь в малой части клеток нужные гены встраиваются в ДНК, причем куда попало. Надо только потом из этих клеток вегетативно вырастить растение.
Второй способ — это агробактерии. Берем бактерии из почвы, которые сами умеют редактировать геном растений. Есть у этих бактерий особая плазмида, часть генетического содержимого которой и передается в растительную клетку. Дальше редактируем эту плазмиду, делаем так, чтобы бактерия передавала растению не гены, нужные ей, а гены, нужные нам. И подсаживаем бактерию к растению.
Проблема в том, что мы снова не контролируем, где именно случится вставка. Это не страшно: мы всегда можем отследить, где она произошла, и если нам не понравится результат, переделать. Есть и еще один нюанс. Эту плазмиду нужно подготовить. Прежде чем какой-то генетический материал куда-то передать, надо получить нужную нам генетическую конструкцию. Это Cas9 умеет разрезать практически все, на что мы его натравим. А раньше, если ты хотел разрезать ДНК в нужном месте, изволь найти специальный фермент, который разрезает именно нужную последовательность букв-нуклеотидов.
Вот картинка, на ней кольцевая молекула ДНК, плазмида.
На картинке видны разные загадочные слова – и рядом с ними цифры. Это позиции, на которых конкретный фермент, например, Ecor1, может разрезать ДНК. И можно выбирать только из этих вариантов. Ферментов таких известно много. И все равно, такие ферменты, как правило, ищут очень короткие фрагменты ДНК. А значит, в длинной ДНК они обязательно разрежут не только там, где надо, будут ложные срабатывания. Да и вообще… куча мороки. Учёным приходится создавать специальные плазмиды, которые идут с набором ферментов, чтобы в пробирке можно было разрезать плазмиду в строго определенном месте и что-то туда вставить. Да ещё следить, чтобы вставка не содержала то, что режут наши ферменты.
Теперь понятно, насколько удобнее генетические ножницы CRISPR-Cas9. Они могут сделать разрез где угодно, с высокой точностью. Обычные ферменты узнают 6--8 нуклеотидов, а здесь требуется совпадение около 20.
Представьте, что у вас есть товарищи Майоры. Они ловят врагов государства. В старой версии генной модификации мы давали ему примерное описание. Рыжие волосы, любит Булгакова, бегает вприпрыжку. Потом сбрасываете этого агента с парашютом в случайном месте страны, и он бродит по городам и ищет этого человека. Разумеется, порой достается рандомным людям. А с молекулярными ножницами ваш агент получает номер паспорта, доступ ко всем базам и камерам в стране. А дальше пробивает человека по базам, ищет по камерам и находит.
Есть у CRISPR-Cas9 и минусы. Система CRISPR-Cas9 иногда ошибается. Иногда CRISPR создает мутации не там, где просили. Это называется off-target mutation, мутация вне мишени.
Вашему агенту ФСБ дали задание – ликвидировать Васю Петина. А мимо пробегал Петя Васин, и пуля досталась ему. А может, и еще паре граждан. Шанс промаха небольшой, но чем больше размер толпы – размер генома, тем больше вероятность попасть не в того.
Именно поэтому так сурово критиковали китайского ученого, который генномодифицировал человеческие эмбрионы, чтобы привить им устойчивость к ВИЧ. В принципе, идея разумная. Мы знаем конкретный вариант гена, который дает этот иммунитет, и его можно привить человеку. Нескольких пациентов вылечили от ВИЧ, пересаживая им костный мозг от доноров с этой мутацией.
Хэ Цзянькую предъявили сразу три серьезных претензии. Во-первых, что будет, если мутация попала мимо цели? Шанс небольшой, но он есть. С табаком или кукурузой это не проблема, десять плохих кустов выросло, вы их выкинули и посадили одиннадцатый. А тут живой ребенок, которому с этой мутацией жить. Во-вторых, во вмешательстве не было медицинской необходимости. Это процедура, без которой можно обойтись. Причем обойтись даже у детей от ВИЧ-инфицированными родителей. Хэ Цзянкуй говорил, что процедура нужна, так как в паре у отца был ВИЧ. Но сегодняшняя медицина без всякой генной инженерии позволяет ВИЧ-положительному отцу иметь незараженное потомство. И в-третьих, если что-то пойдет не так, это нанесет гигантский удар по репутации современной генетики и генной инженерии. И это не говоря о том, что Хэ Цзянькуй, судя по всему, не очень правильно внес сами изменения. Поэтому сам иммунитет к ВИЧ у детей может и не работать. А ещё он сделал все тайком, без возможности независимо перепроверить все процедуры.
Но я считаю, что, если подойти к этому вопросу обстоятельно, то, использовать CRISPR-Cas9 на благо людям, в том числе эмбрионам, можно и нужно. У меня в школе был учитель молекулярной биологии, Денис Ребриков. Сейчас он проректор по научной работе Пироговского университета. Он и его научная команда утверждают, что создали способ избавить людей от врожденной глухоты на базе CRISPR-Cas9. Есть ген, который нужно поправить. Пока им удалось сделать это в пробирке, на клетках. Им не терпелось испытать эту терапию на детях, у которых вероятность родиться глухими близка к 100%. Причина, по которой этого не случилось, возможно, вас удивит. По ряду причин сами родители не соглашаются на эту процедуру. И вовсе не из-за опасений, что что-то пойдет не так. А из опасений, что все пойдет «так». И со временем будет утрачена уникальная культура глухонемых людей. Так что вопрос модификации людей социально спорный и сложный. Мне-то ответ очевиден, но как сделали бы вы?
Как сделать CRISPR безопаснее
Но что же насчет off-target mutations? Как бы нам доработать CRISPR/Cas9? Ученые не сидели сложа руки – и придумали уже несколько способов избегать рисков метода. Например, они научились модифицировать инструмент для генной модификации. Редактировать сам белок Cas9, вносить в него мутации, чтобы он стал точнее или даже получил совершенно новые способности. Самый простой пример – это тренировка точности. Берем ген, который кодирует белок CaS9. Вносим в него случайные мутации и отбираем те версии, которые точнее режут и создают меньше мутаций «мимо мишени». Получается искусственная эволюция белка-снайпера.
А можно сделать по-другому. ДНК — двойная спираль. В норме Cas9 разрезает двойную спираль целиком. А тут ученые создали специальную версию Cas9, которая режет только одну из двух нитей. И тут была хитрая идея. Обычно Cas может распознать фразу из нуклеотидов длиной максимум в 20 букв. Это вообще-то много, в несколько раз больше других способов. Но что, если мы хотим ещё точнее – и ищем точную фразу длиной в 40 букв? Все-таки у нас в геноме целых 3 миллиарда этих букв. Там может и случайно найтись фраза из 20 букв. А вот чем длиннее фраза в окошке поиска, тем меньше шансов на ошибку.
А теперь смотрите. Мы даем одному Cas9 задание на первые 20 букв кодовой фразы. Второму Cas9 – на вторые 20 букв. При этом первый умеет разрезать только левую цепочку, а второй правую. ДНК разорвется, только если все 40 букв окажутся рядом. А если сработал только один Cas9, то ДНК не разорвется. Это снижает вероятность ошибок, когда мутации вносятся «не туда».
Но и это не предел. Другая группа ученых придумала еще более хитрый ход. Они разучили Cas9 разрезать ДНК в принципе. Такой Cas9 может только распознать нужное место, прилепиться к нему, а разрезать уже не может. Дальше они приделали к этим «тупым ножницам» половину другого белка, который умеет разрезать ДНК. Теперь разрез произойдет только если в нужном месте приземлятся сразу два разных Cas. У каждого своя половинка ключа — тоже, скажем, по 20 букв. И если все 40 сошлись, то настоящие острые половинки ножниц воссоединяются и режут в нужном месте.
Генетический выключатель
Допустим, я не хочу насовсем изменить ДНК, а желаю в нужный момент отключить какой-то ген, а в другой его активировать. В каждой клетке с ядром у нас содержится весь наш геном целиком. Но не в каждой клетке работают все 20 000 генов. Активны лишь те, которые нужны этой клетке, а остальные спят. А некоторые гены включаются по сигналу. И вот представьте себе. Вам предстоит вечеринка, и вы хотите заранее выработать запас фермента для расщепления алкоголя, чтобы всех перепить и уложить под столы. Пожалуйста! Берем еще один генномодифицированный Cas9. Он точно наводится на нужные 20 нуклеотидов. Но ДНК не разрезает, а химически «щелкает тумблером» — действует на специальные эпигенетические метки-выключатели. Включает или выключает ген, в зависимости от обстоятельств.
На людях пока этого никто не делал, но если бы сделали, то это выглядело бы так: находим нужный ген, который активирует переработку алкоголя. Создаем два специальных состава, которые могут этот ген переключить, авторы их называют CRISPR-ВКЛ и CRISPR-ВЫКЛ. Дальше вводим их в тело в футляре-вирусе, который нацелен на проникновение в клетки печени. Все готово к использованию.
Когда я собираюсь на вечеринку, я принимаю специальное вещество-триггер А, которое активирует CRISPR-ВКЛ. У меня резко вырастает выработка фермента расщепления алкоголя, и я не пьянею весь вечер. Наутро я принимаю другое вещество-триггер Б, и выключаю этот режим. Или не выключаю.
Естественно, не все так просто. Тут обязательно обнаружится куча подводных камней, а может и побочных эффектов. Но благодаря модифицированным белкам Cas9 мы очень близки к настоящей научной фантастике.
Заключение
CRISPR-CaS9 – не единственный метод генетической инженерии. CRISPR-Cas9 оказался самым хайповым и удобным, поэтому мы все время про него слышим. Но это по-настоящему большой прорыв. И, кстати, Нобелевскую премию за него могли дать даже раньше. В научной среде многие считают, что Нобелевский комитет медлил только потому, что долго не мог разобраться, кому же на самом деле принадлежит патент на изобретение.
Да, вокруг CRISPR-Cas9 развернулась целая патентная война. С одной стороны были Дудна и Шарпентье, которые в итоге получили премию, с другой – ученые из гарвардского института Броуда. А в целом на тему технологии CRISPR-Cas9 уже зарегистрировано больше 11 тыс. групп патентов. А также опубликовано почти 30 000 научных статей. Оцените взрывное развитие технологии: до 2012 года про Cas9 выходило 1-2 статьи в год. А после 2012, когда доказали действенность метода, выходят уже тысячи статей каждый год. Вот как выглядит настоящая Нобелевская премия.
Для биологии открытие CRISPR-CaS9 — примерно как открытие двигателя внутреннего сгорания. До двигателя уже вовсю развивалась индустрия. Уже были паровые двигатели на фабриках, везде были паровозы, пароходы и даже экскаваторы. Даже электромобили и трамваи уже пробовали делать. Но когда изобрели моторы на бензине и дизеле, все изменилось. За каких-то 20 лет города заполнили легковушки, грузовики, автобусы. В небо поднялись самолеты и вертолеты. Цивилизация преобразилась.
Так и взрыв в генетической инженерии уже произошел на наших глазах. Молекулярные ножницы — пока что самое влиятельное открытие биологии в XXI веке. Но это пока что.
Источники


Свежие комментарии