В журнале Cell опубликована статья, посвященная особенностям регулирования экспрессии генов у печеночного мха маршанции изменчивой (Marchantia polymorpha). Авторы обнаружили в ДНК маршанции N4-метилцитозин — эпигенетическую модификацию, ранее описанную только у прокариот. Они предполагают, что ген, необходимый для внесения этой модификации, был получен от бактерий путем горизонтального переноса. Маршанции N4-метилцитозиновые метки необходимы для нормального сперматогенеза.
Экспрессия гена — это преобразование наследственной генетической информации, которую несет ген, в белок или, реже, в некодирующую РНК. Если говорить кратко, это синтез продуктов гена. Разумеется, не все гены в организме (и даже в отдельно взятой клетке) в каждый момент времени должны экспрессироваться с одинаковой интенсивностью: например, гены, задействованные в эмбриональном развитии (в частности, некоторые гомеозисные гены группы Hox), могут быть или совсем не нужны взрослому организму, или нужны лишь «чуть-чуть». А значит, клетки должны уметь регулировать интенсивность экспрессии. Активность генов требует тонкой настройки в зависимости от множества факторов: как внутренних (например, стадии развития организма), так и внешних (в частности, условий окружающей среды).
Экспрессия генов может регулироваться многими путями. Пожалуй, самый простой способ инактивировать ген — сделать так, чтобы белки, отвечающие за транскрипцию, просто не сумели к нему подобраться. Для этого нужно уплотнить хроматин в районе гена, а точнее — его промотора (области, с которой начинается транскрипция). Обратный процесс — разрыхление хроматина — приводит к активации гена, так как теперь он становится открыт для связывания с разными белками.
Локальная регуляция структуры хроматина может достигаться разными способами. Один из основных — ковалентное присоединение различных химических групп к гистонам — белкам, которые связывают двойную спираль ДНК. Но не менее распространена другая эпигенетическая модификация, затрагивающая уже саму ДНК, — метилирование, то есть присоединение метильной группы –CH3. В отличие от модификаций гистонов, которые могут оказывать как подавляющее, так и активирующее воздействие на экспрессию генов, метилирование ДНК всегда приводит к отключению гена. Кроме того, к гистонам могут присоединяться самые разные химические группы — ацетильная, фосфатная и многие другие, а к ДНК присоединяется только метильная группа. Ингибирующий эффект метилирования ДНК связан с тем, что метильные группы не дают связываться с генами белкам, необходимым для их экспрессии. В то же время модификации гистонов могут приводить к самым разным перестройкам хроматина, поэтому функциональное значение многих их модификаций зависит от того, в какой участок молекулы гистона они были внесены.
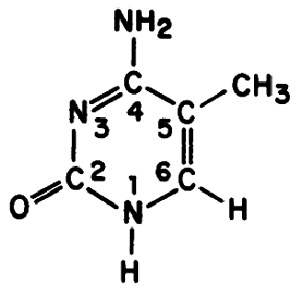
Ферменты, которые ковалентно «пришивают» метильные группы к ДНК, называются ДНК-метилтрансферазами. Чаще всего метилированию подвергаются азотистые основания цитозин и аденин, однако метильные группы могут быть присоединены к разным атомам в их составе. Например, у прокариот присутствуют две формы метилированного цитозина — N4-метилцитозин (4mC) и 5-метилцитозин (5mC), также у них встречается метилированный аденин — N6-метиладенозин (6mA) (цифры указывают на номер атома в молекуле, к которому присоединена химическая группа — в данном случае, метильная). Считалось, что модификация 4mC уникальна для прокариот, а у эукариот преимущественная форма метилированной ДНК — 5mC, хотя некоторые группы эукариот утратили ее в процессе эволюции.
Важный аспект метилирования ДНК у ряда эукариот — репрограммирование, в ходе которого метильные метки по всему геному убираются, а затем вносятся заново. Так происходит, в частности, в клетках зародышевой линии у млекопитающих, этот процесс играет важную роль в нормальном эмбриональном развитии будущего зародыша. Так, именно благодаря репрограммированию в зиготе запускается правильная программа экспрессии генов, которая необходима для ранних этапов развития зародыша(H. Morgan et al., 2005. Epigenetic reprogramming in mammals). Репрограммирование встречается и у растений. Так, у цветковых репрограммирование происходит во время сперматогенеза и необходимо для размножения. У прокариот эпигенетическое репрограммирование не описано (A. Willbanks et al., 2016. The Evolution of Epigenetics: From Prokaryotes to Humans and Its Biological Consequences).
Итак, растения используют метилирование ДНК для регуляции экспрессии генов. Но на каком этапе эволюции они приобрели эту способность? Могли ли они «унаследовать» способность к метилированию ДНК у своих прокариотических предков? Авторы недавней работы, опубликованной в журнале Cell, для ответа на этот вопрос обратились к одному из самых примитивных наземных растений — печеночному мху (или просто печеночнику) маршанции изменчивой (Marchantia polymorpha, см. картинку дня Маршанция). Последний общий предок маршанции и цветковых растений жил примерно 450 миллионов лет назад. Вегетативная часть маршанции — слоевище (или таллом) — по форме напоминает листья.
Метилирование ДНК у маршанции уже исследовали (M. Schmid et al., 2018. Extensive epigenetic reprogramming during the life cycle of Marchantia polymorpha; S. Takuno et al., 2016. Evolutionary patterns of genic DNA methylation vary across land plants). Было показано, что расположение нуклеотидов с 5-метилцитозином у нее в среднем не отличается от такового у цветковых. Однако есть и отличия: у маршанции, например, в отличие от цветковых, 5-метилцитозин не встречается в генах, причем эта особенность наблюдается и у других «древних» наземных растений, например, мха фискомитреллы раскрытой (Physcomitrella patens) и плаунка Мёллендорфа (Selaginella moellendorffii). Иными словами, метильные метки у маршанции и у цветковых в среднем расположены в геноме схожим образом, вот только в кодирующих гены областях метилирования нет. У цветковых же некоторые гены метилированы. Важно отметить, что репрограммирование, как показали предыдущие исследования (M. Schmid et al., 2018. Extensive epigenetic reprogramming during the life cycle of Marchantia polymorpha), характерно и для маршанции: если геном вегетативных тканей метилирован более-менее мозаично, то в сперматозоидах наблюдается глобальное метилирование, так что мужской гаметогенез сопровождается репрограммированием метильных меток. Все эти метки представляют собой 5-метилцитозин.
Описанные результаты могут быть неполными. Дело в том, что использующиеся сейчас методы секвенирования, направленные на выявление метильных меток, «заточены» преимущественно на 5mC, и другие модификации могли «ускользнуть» в предыдущих исследованиях. Авторы обсуждаемой работы детально описали репрограммирование у маршанции в свете метилирования ДНК и показали, что, помимо 5mC, у нее встречается форма метилированного цитозина, которая считалась уникальной для прокариот — 4mC.
Вначале ученые выделили зрелые сперматозоиды маршанции, а также антеридии (мужские половые органы) на поздних стадиях сперматогенеза. Антеридии исследовали как с помощью микроскопии, чтобы определить, какая конкретно стадия сперматогенеза в них протекает, так и с помощью секвенирования РНК и бисульфитного секвенирования, которое выявляет метильные метки. Было показано, что репрограммирование при сперматогенезе идет в две волны посредством интенсивного метилирования ДНК. В первую волну метильные метки присоединяются к остаткам цитозина, которые не находятся в контексте CG, то есть не присоединены ковалентно к остаткам гуанина. Если на ранних этапах сперматогенеза у круглых сперматид доля таких модификаций составляет 35%, то у зрелых сперматозоидов она достигает 96%. Вторая волна захватывает последнюю стадию сперматогенеза и включает метилирование цитозина в контексте CG. В итоге в зрелом сперматозоиде метилировано 94% генома (для сравнения, в талломе метилирован всего лишь 21% генома). Столь масштабное метилирование до этого было описано только в клетках зародышевой линии у млекопитающих. По всей видимости, низкий уровень метилирования у гаплоидного поколения (таллом) и диплоидного (спорофит) связан с тем, что после оплодотворения ДНК сперматозоидов подвергается мощному деметилированию. Можно предположить, что, как и в других случаях репрограммирования, связанных с размножением, маршанции оно необходимо для нормального развития будущих растений.
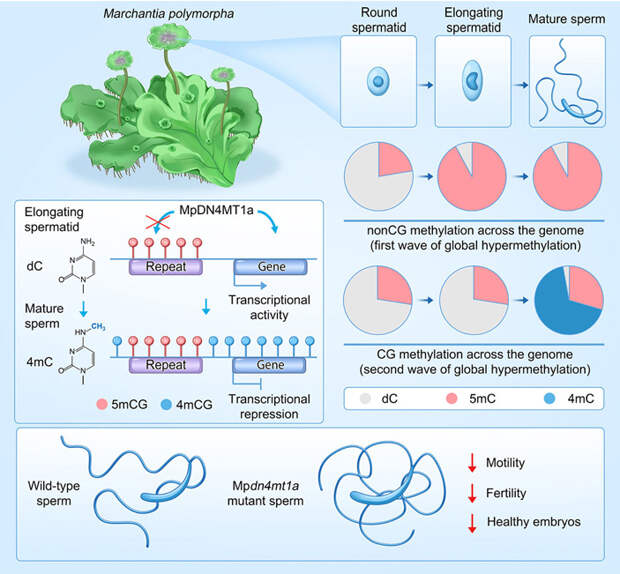
Авторы подметили, что на поздних стадиях сперматогенеза возрастает уровень экспрессии генов, белковые продукты которых гомологичны N4-цитозинметилтрансферазам прокариот, вносящим метку 4mC. Наиболее активно транскрибировались два тандемно удвоенных гена, которые показали высокое родство с генами, кодирующими N4-цитозинметилтрансферазы. Более того, выяснилось, что соответствующие гены есть во всех отсеквенированных геномах печеночников, но не обнаруживаются у каких-либо других растений. По всей видимости, печеночники заполучили бактериальный ген посредством горизонтального переноса. Среди других эукариот гомологи N4-цитозинметилтрансфераз были выявлены у коловраток, которые, вероятно, тоже приобрели эти гены от бактерий путем горизонтального переноса. Два гомолога N4-цитозинметилтрансфераз, выявленных у маршанции, получили название MpDN4MT1a и MpDN4MT1b.
Дальнейшие исследования показали, что метка 4mC присутствует аж на 14,8% остатках цитозина в сперматозоидах, а за внесение этой метки отвечает белок MpDN4MT1a. Внесение 4mC происходит на поздних стадиях сперматогенеза, когда начинается процесс компактизации ДНК, и авторы работы предположили, что 4mC может участвовать в этом процессе. Действительно, оказалось, что 4mC снижает доступность хроматина в сперматозоидах. Более того, 4mC задействован в остановке транскрипции в зрелых сперматозоидах. Более детальный анализ позволил установить, что 4mC покрывает точку старта транскрипции и действует как репрессивная метка, причем в тех генах, в которых нет метилирования 5mC.
Но зачем маршанции нужна альтернативная форма метилирования ДНК, если есть 5mC? Оказалось, что 4mC выполняет довольно специфические функции. Чаще всего она вносится в гены, которые так или иначе связаны с подвижностью клеток, несущих жгутики, то есть сперматозоидов. Вероятно, транскрипция этих генов идет еще до полного созревания сперматозоидов, на стадии сперматид, а считанная с них мРНК присутствует в зрелых сперматозоидах, так как транскрипция в них подавлена. Чтобы оценить влияние 4mC на фенотип, авторы работы исследовали свойства сперматозоидов, нокаутных по MpDN4MT1a. Выяснилось, что мутантные сперматозоиды отстают от сперматозоидов дикого типа по скорости плавания и направленности движения. Поскольку у маршанции подвижность сперматозоидов имеет решающее значение для успешного оплодотворения, 4mC играет важнейшую роль в обеспечении нормального размножения.
Источник: James Walker, Jingyi Zhang, Yalin Liu, Martin Vickers, Liam Dolan, Keiji Nakajima, Xiaoqi Feng. Extensive N4 cytosine methylation is essential for Marchantia sperm function // Cell. 2025. DOI: 10.1016/j.cell.2025.03.014.
Елизавета Минина


Свежие комментарии