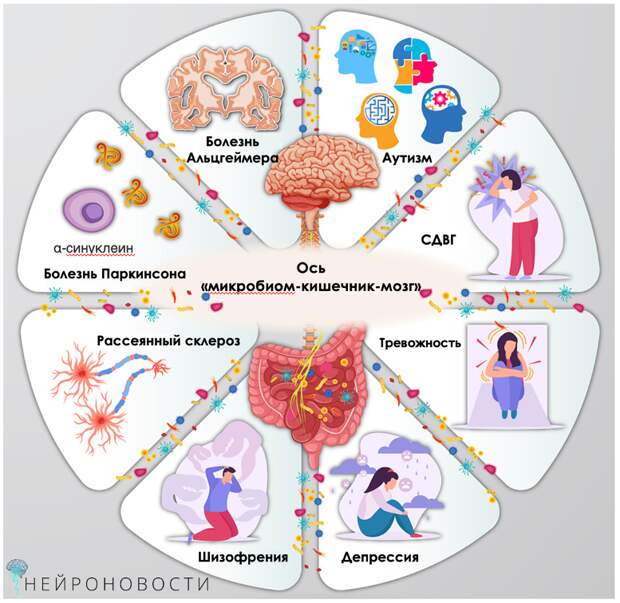
В последние годы ученые все больше внимания уделяют изучению связи между кишечником, мозгом и иммунной системой. Эта связь, известная как ось «микробиом-кишечник-мозг», играет ключевую роль в поддержании здоровья человека, влияя на пищеварение, работу мозга и даже на наше поведение. Новые исследования показывают, что кишечные бактерии могут быть ключом к лечению психических, неврологических заболеваний и болезней развития. Свежий обзор из журнала Cell Reports Medicine рассказывает о последних открытиях в этой области и о том, как они могут изменить наше понимание здоровья и патогенеза некоторых недугов.
Credit: Kenneth J. O’Riordan et al. / Cell Reports Medicine 2025
Кишечник и мозг: как они общаются?
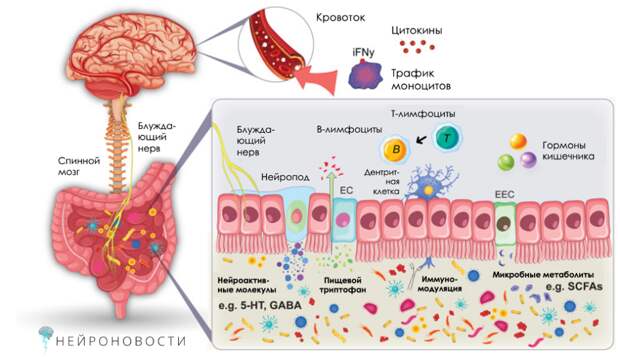
Кишечник и мозг связаны через сложную сеть нейрональных и химических сигналов. Одним из главных «посредников» в этом общении выступает иммунная система. Кишечные бактерии влияют на работу как врожденного, так и адаптивного иммунитета, что, в свою очередь, может влиять на состояние мозга. Например, дисбаланс в микробиоме может привести к нейровоспалению, которое связано с депрессией, расстройствами аутистического спектра и болезнью Паркинсона.
Механизмы связи между кишечной микробиотой, иммунитетом и мозгом. Credit: Kenneth J. O’Riordan et al. / CellReports Medicine 2025
Исследования показывают, что кишечные бактерии могут влиять на мозг через несколько путей: через блуждающий нерв, нервную систему кишечника, эндокринную систему и выработку различных метаболитов, типа короткоцепочечных жирных кислот (КЖК). Эти вещества не только регулируют иммунные реакции, но и влияют на настроение, когнитивные функции и поведение.
Иммунная система играет ключевую роль в поддержании баланса между кишечником и мозгом. Врожденный иммунитет, который представляет собой первую линию защиты организма, реагирует на сигналы от кишечных бактерий, запуская воспалительные процессы. Адаптивный иммунитет, с другой стороны, обеспечивает более специфический ответ, помогая организму справляться с инфекциями и поддерживать толерантность к полезным бактериям.
Нарушения в работе иммунной системы, вызванные дисбалансом микробиома, могут привести к развитию различных патологических процессов. Например, хроническое воспаление, связанное с дисбиозом кишечника, может способствовать развитию депрессии, тревожных расстройств и даже нейродегенеративных заболеваний, включая болезнь Альцгеймера.
Кишечные бактерии и психическое здоровье
Одной из самых интересных тем в исследованиях оси «микробиом-кишечник-мозг» считается их связь с психическим здоровьем. Ученые обнаружили, что у людей с депрессией и тревожными расстройствами часто наблюдается дисбаланс кишечных бактерий. Например, у пациентов с депрессией снижено количество бактерий рода Coprococcus и Dialister, которые связаны с улучшением качества жизни.
Эксперименты на животных показали, что трансплантация микробиома от людей с депрессией здоровым мышам вызывает у последних симптомы депрессии. Это говорит о том, что кишечные бактерии могут напрямую влиять на настроение и поведение. Кроме того, пробиотики, содержащие определенные штаммы бактерий, такие как Lactobacillus и Bifidobacterium, показали свою эффективность в улучшении симптомов депрессии и тревожности.
Стресс тоже оказывает значительное влияние на состав и функцию кишечного микробиома. Исследования демонстрируют, что хронический стресс меняет виды населяющих кишечник бактерий, что, в свою очередь, влияет на иммунную систему и поведение. Например, у мышей, подвергшихся хроническому стрессу, наблюдались изменения в микробиоме, которые приводили к повышению уровня воспаления и депрессоподобному поведению. Также трансплантация микробиома от мышей, подвергшихся стрессу, здоровым мышам вызывала у последних аналогичные изменения в поведении и иммунной системе.
Кишечный микробиом вносит свою лепту и в расстройства развития – он может способствовать РАС, шизофрении и синдрому дефицита внимания и гиперактивности (СДВГ). У детей с РАС часто наблюдаются изменения в составе кишечных бактерий, включая увеличение количества Bacteroidetes и снижение уровня Bifidobacterium и Lactobacillus, что связано с воспалительными процессами и активацией кишечной иммунной системы. Например, у детей с РАС много провоспалительных цитокинов (IL-5, IL-15 и IL-17), что связывается с нарушением кишечного барьера и повышенной проницаемостью кишечника.
Материнская иммунная активация (МИА) во время беременности, вызванная инфекциями, также увеличиваетриск развития РАС у потомства. Исследования на мышах показали, что МИА приводит к изменению мозговой активности и поведения у потомства, причем ключевую роль в этом процессе играет цитокин IL-17A. Интересно, что материнский микробиом может модулировать эффекты МИА, что открывает возможности для профилактических вмешательств. Например, использование пробиотиков и пребиотиков в моделях на животных показало, что они могут улучшать социальное поведение и снижать нейровоспаление у потомства, подвергшегося воздействию вальпроевой кислоты (VPA), которая используется для моделирования РАС.
Что касается СДВГ, исследования также указывают на связь между диетой, микробиомом и симптомами этого расстройства. Например, у детей с СДВГ наблюдается увеличение количества бактерий рода Bifidobacterium, что может быть связано с регуляцией дофаминовых предшественников в кишечнике. Диетические вмешательства (например, ограничительные диеты), показали свою эффективность в сглаживании симптомов СДВГ у 63% участников. Кроме того, пробиотики, содержащие Lactobacillus rhamnosus и Bifidobacterium bifidum, могут положительно влиять на поведенческие и когнитивные исходы у детей с СДВГ, хотя для подтверждения этих результатов необходимы дополнительные исследования.
Нейродегенерации и демиелинизации
Кишечные бактерии также играют важную роль в развитии нейродегенеративных заболеваний – болезни Паркинсона (БП) и Альцгеймера (БА). У пациентов с БП часто наблюдается снижение количества бактерий рода Prevotella, что опять же может быть связано с воспалительными процессами в кишечнике и нарушением работы иммунной системы. Кроме того, у пациентов с БП повышено количество бактерий Akkermansia muciniphila, что коррелирует с запорами, которые часто предшествуют диагнозу БП.
Исследования на мышах показали, что кишечные бактерии могут влиять на накопление белка альфа-синуклеина, который играет ключевую роль в развитии БП. Например, у мышей с нарушенным микробиомом альфа-синуклеин в мозге накапливался быстрее, что приводило к ухудшению моторных функций. Более того, по блуждающиему нерву α-синуклеин может подниматься из кишечника в мозг, что подтверждается данными о том, что стволовая ваготомия (то есть его перерезка) снижает риск болезни Паркинсона и останавливает прогрессирование α-синуклеинопатии у мышей.
Что касается болезни Альцгеймера, исследования показывают, что у пациентов с БА часто наблюдается дисбаланс кишечных бактерий, включая снижение количества «полезных» бактерий Eubacterium rectale и Bifidobacterium, и увеличение патогенных бактерий типа Escherichia/Shigella. Эти изменения коррелируют с повышением уровня провоспалительных цитокинов IL-1β и CXCL2, что, в свою очередь, может способствовать развитию нейровоспаления и когнитивных нарушений.
Связь между микробиомом и аутоиммунными заболеваниями сегодня активно изучается. У пациентов с рассеянным склерозом (РС) также наблюдаются изменения в составе кишечных бактерий, которые коррелируют с повышенной активностью воспалительных путей в моноцитах. Например, у пациентов с РС часто снижено количество бактерий рода Lactobacillus, Bifidobacterium и Streptococcus. Пробиотики, содержащие эти штаммы, показали способность успокаивать воспаление и улучшать состояние пациентов с РС.
Исследования на моделях экспериментального аутоиммунного энцефаломиелита (ЭАЭ, модель РС у животных) показали, что пробиотики могут уменьшать потерю миелина и способствовать развитию толерантных дендритных клеток (ДК). Например, по этому пути идет пробиотик Lactibiane Iki, который улучшил клинические исходы у мышей с ЭАЭ. Это указывает на то, что модуляция микробиома может помочь в управлении аутоиммунными реакциями при РС.
Кроме того, бактерии Saccharomyces cerevisiae и селенсодержащий препарат на их основе Selemax увеличивают количество CD103+ дендритных клеток, которые играют ключевую роль в поддержании иммунной толерантности, и снижают кишечное воспаление. Это подчеркивает важность взаимодействия между кишечным микробиомом и иммунной системой в контексте аутоиммунных заболеваний.
Молекулярная мимикрия также имеет место в развитии аутоиммунных заболеваний. Например, бактерия Lactobacillus reuteri способна производить пептиды, которые имитируют миелиновый олигодендроцитарный гликопротеин (MOG), что может усугублять аутоиммунные реакции при РС. Трансплантация фекальной микробиоты от пациентов с РС стерильным мышам ухудшала симптомы ЭАЭ, снижая количество регуляторных T-клеток (Tregs) и усиливая выработку антител против MOG. Это указывает на то, что микробиом пациентов с РС может способствовать развитию аутоиммунных реакций. Однако предварительное лечение антибиотиками перед трансплантацией увеличивало количество регуляторных T- и B-клеток, что снижало тяжесть энцефаломиелита.
То есть если научиться управлять микробиомом, то это может стать перспективным подходом для лечения (или хотя бы сопутствующей терапии) аутоиммунных заболеваний.
Микробиом для лечения?
В данный момент методы лечения, направленные на модуляцию микробиома, только разрабатываются. Среди них – пробиотики, пребиотики, постбиотики, синбиотики и трансплантация фекальной микробиоты (ТФМ).
Пробиотики – это живые микроорганизмы. Например, штаммы Lactobacillus и Bifidobacterium показали свою эффективность в улучшении настроения и снижении уровня воспаления. Пребиотики – неперивариваемые субстраты для питания бактерий, например, фруктоолигосахариды (ФОС) и галактоолигосахариды (ГОС), стимулируют рост полезных бактерий в кишечнике, что может положительно влиять на психическое здоровье. Постбиотики – инактивированные (убитые) бактерии – могут оказывать антидепрессантное действие.
Синбиотики, сочетающие пробиотики и пребиотики, также показали свою эффективность в улучшении как кишечного, так и психического здоровья. Например, синбиотик, содержащий Lactobacillus helveticus и Bifidobacterium longum, сгладил симптомы у пациентов с умеренной депрессией.
Трансплантация фекальной микробиоты (ТФМ) – это перенос микробиома от здорового донора к пациенту. Этот метод уже успешно применяется для лечения инфекций, вызванных Clostridium difficile, и сейчас исследуется его потенциал в лечении депрессии и тревожности.
Одна из главных задач будущих исследований – понять, как именно кишечные бактерии влияют на мозг и иммунную систему. Ученые планируют использовать все передовые технологии, которые им доступны – к примеру, CRISPR для редактирования генома бактерий и искусственный интеллект для анализа больших объемов данных. Это позволит разработать более точные и персонализированные методы лечения.
Кроме того, важно учитывать влияние циркадных ритмов на микробиом и иммунную систему. Исследования показывают, что активность кишечных бактерий и иммунных клеток меняется в течение суток, что может влиять на эффективность вмешательства, и это нужно брать в расчет.
Текст: Анна Хоружая
The gut microbiota-immune-brain axis: Therapeutic implications by Kenneth J. O’Riordan et al. in Cell Reports Medicine. Published March, 2025
DOI: 10.1016/j.xcrm.2025.101982
Читайте материалы нашего сайта во ВКонтакте, Яндекс-Дзен и канале в Telegram
Свежие комментарии