

В этом году Нобелевский комитет присудил премию по физиологии и медицине американским биологам Виктору Эмбросу (Victor Ambros) и Гэри Равкану (Gary Ruvkun) «за открытие микроРНК и их роли в посттранскрипционной регуляции генов». Фактически премия была вручена за открытие в области фундаментальной биологии: микроРНК необходимы для специализации дифференцировки клеток в сложных организмах многоклеточных эукариот. Однако прямого медицинского применения это открытие пока не нашло.
В конце 1980-х годов Виктор Эмброс (Victor Ambros) и Гэри Равкан (Gary Ruvkun) работали в лаборатории Роберта Хорвица — молекулярного генетика, который впоследствии, в 2002 году, сам получил Нобелевскую премию за открытие генов, регулирующих запрограммированную смерть клетки.
Эмброс и Равкан изучали мутантных особей нематоды Caenorhabditis elegans — маленького круглого червя, который всего за два десятилетия до того был освоен биологами в качестве модельного объекта. У этого червя мало клеток (около тысячи), судьба каждой из них — даже нейронов! — хорошо прослеживается, к тому же все тело у него прозрачное. Это сделало нематоду очень удобным организмом для изучения фундаментальных молекулярно-биологических процессов, управляющих развитием животных (рис. 2).
Эмбросу и Равкану достался проект по изучению системы из двух генов, ранее идентифицированных лабораторией Хорвица. Еще в 1970-х годах в ходе очередного скрининга мутаций был обнаружен интересный фенотип: мутация в гене lin-4 радикально нарушала развитие червя. Многие клетки и ткани у него отсутствовали, включая ткани вульвы. При этом у червей с мутацией в организме накапливались яйца, несмотря на то, что им нечем было их откладывать (рис.
3). Все выглядело так, что в организме червя-мутанта программы развития некоторых тканей запускаются раз за разом по кругу — вместо того, чтобы сработать однократно в положенное время. До исследований Эмброса и Равкана удалось лишь выяснить, что ген lin-4 регулирует активность другого гена, lin-14, мутации в котором приводят к остановке развития на стадии личинки.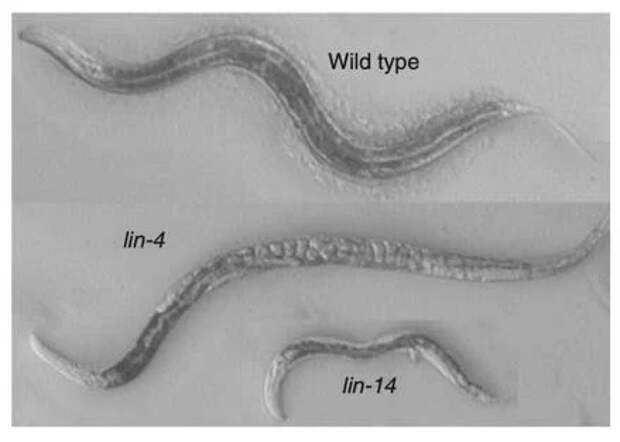
В ходе своих исследований Эмброс и Равкан открыли, что продукт гена lin-14 — это ядерный белок, экспрессирующийся на одной из стадий развития червя. Его экспрессия менялась как при мутациях в самом lin-14, так и при мутации в гене lin-4, — которая была идентифицирована всего одна, при том что для lin-14 в каталоге лаборатории присутствовало несколько мутаций. Кроме того, когда Эмброс и Равкан попытались определить местоположение гена lin-4 на хромосоме, его открытая рамка считывания оказалась неожиданно короткой. Транскрибированная с этого участка РНК явно не могла кодировать какой-либо функциональный белок! Это навело исследователей на мысль, что этот участок ДНК не кодирует белок, а выполняет регуляторную роль.
Это предположение удалось подтвердить с помощью изящного эксперимента. В кодирующем белок гене удаление или удаление одного нуклеотида смещает все триплеты генетического кода на одну позицию, что затрагивает каждую аминокислоту в белке, меняя ее на какую-то другую. Вместос взяног отекстап олучаетсяп олнаяб ессмыслица. Понятно ли вам предыдущее предложение? Скорее всего, смысл вы поняли, но каждое слово в нем — просто набор букв. Вот и белок получается нефункциональным. Такая мутация называется сдвигом рамки считывания. Но если продукт гена — РНК, у которой нет свойства триплетности, то аналогичная мутация может не лишить ее функциональности. Ген lin-4 оказался устойчив к сдвигу рамки считывания — это подтвердило реализацию его функции не через белок, а через РНК.
Последним кусочком мозаики стало обнаружение в гене lin-14 мутации c приобретением функции (gain-of-function): делеция в нетранслируемом регионе с 3'-конца (3'-UTR) приводила к повышению экспрессии гена lin-14 от 4 до 7 раз и потере управления со стороны lin-4. Этот регион и был местом связывания для РНК lin-4.
В общих чертах механизм действия lin-4 довольно прост: продуктом этого гена служит очень короткая РНК, которая не транслируется в белок. Вместо этого она связывается с белок-кодирующей РНК lin-14, блокируя ее трансляцию и облегчая связывание с белками, запускающими ее разрушение. При мутации в гене lin-4 этот тормозящий механизм «ломается», и сразу во многих тканях процессы дифференцировки, управляемые белком lin-14, запускаются не в свое время. В результате до развития некоторых органов (типа вульвы) дело так и не доходит. Зато, например, яйца начинают штамповаться десятками, невзирая на то, что их еще некуда выводить.
Ген lin-4 оказался первым открытым геном, кодирующим микроРНК. Истинный масштаб распространения микроРНК стал понятен несколькими годами позже, когда в лаборатории Гэри Равкана открыли еще одну микроРНК — let-7 (B. Reinhart et al., 2000. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans). У червя она, как и многие другие микроРНК, обеспечивает запуск процессов развития в правильное время, то есть работает своеобразным «таймером» клеточных процессов (V. Ambros. 2008. The evolution of our thinking about microRNAs). Ее гомологи обнаружились почти у всех животных. Стало понятно, что микроРНК — фундаментальный механизм регуляции развития клеток у многоклеточных эукариот.
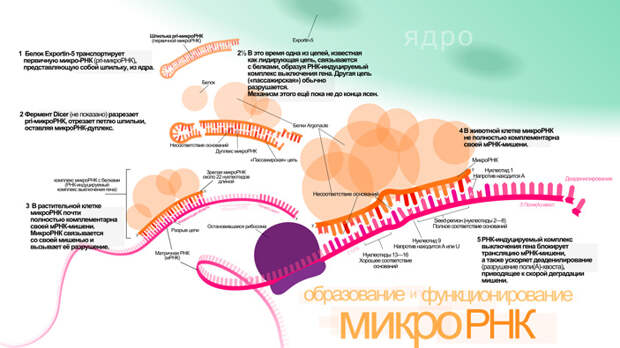
В 2001 году в своем кратком обзоре в журнале Science Гэри Равкан упоминает уже 100 открытых «маленьких РНК» и тогда же вводит для них ставший общепринятым термин — микроРНК (G. Ruvkun, 2001. Glimpses of a Tiny RNA World). Сейчас только у человека открыто около 1800 микроРНК, и их число продолжает прибывать. Помимо животных, они описаны почти у всех многоклеточных эукариот, включая растения. Однако микроРНК растений и животных эволюционно не родственны друг другу и развились независимо, поэтому даже связывание с РНК-мишенью у них устроено немного по-разному. Несмотря на это, все микроРНК представляют собой очень короткие РНК длиной примерно 22 нуклеотида, и все они связываются с 3'-UTR мРНК-мишеней (рис. 4). Обычно это приводит к блокированию трансляции и запуску разрушения мРНК, но в некоторых случаях может приводить к активации трансляции за счет активности белков, присоединяющихся к комплексу микроРНК-мРНК (см. статью МикроРНК — чем дальше в лес, тем больше дров). Мишенями микроРНК обычно являются РНК, транскрибированные с генов, кодирующих важные для развития белки.
У одноклеточных эукариот микроРНК есть, но только у некоторых видов и единичные в геноме. Чем организм сложнее, тем больше у него микроРНК — сильнее всего их количество коррелирует с многоклеточностью. С появлением многоклеточности в разных линиях эукариот микроРНК возникали независимо, и эта конвергентная эволюция происходила минимум несколько раз: не только у растений и животных, но даже у слизевиков с их довольно простой агрегативной многоклеточностью (J. Tarver et al., 2015. microRNAs and the evolution of complex multicellularity: identification of a large, diverse complement of microRNAs in the brown alga Ectocarpus; B. Edelbroek et al., 2024. Evolution of microRNAs in Amoebozoa and implications for the origin of multicellularity). А начало эволюции позвоночных сопровождалось всплеском появления новых микроРНК — не имеющим аналогов в эволюции хордовых (A. Heimberg et al., 2008. MicroRNAs and the advent of vertebrate morphological complexity).
Вопрос о том, что было раньше — микроРНК или многоклеточность — сродни извечному вопросу о курице и яйце. Переход от одноклеточных форм к многоклеточным требует приобретения сложного аппарата для дифференцировки клеток — а для нее, в свою очередь, необходимы средства «выключения» и «выключения» отдельных генов или их групп. С другой стороны, пока клетки не начали жить и работать сообща, нет самой потребности в регуляции и давления отбора в ее сторону. МикроРНК — это не единственные известные «выключатели» генов. Например, существует множество транскрипционных факторов — белков, которые управляют транскрипцией генов, действуя на этапе копирования информации с ДНК на мРНК. МикроРНК — это дополнительный «слой» регуляции активности генов уже на уровне трансляции — то есть синтеза белка. Тот факт, что разные группы эукариот приходили независимо к столь похожему решению, позволяет предположить, что этот «слой» регуляции необходим для полноценной дифференцировки, и одних только транскрипционных факторов недостаточно.
Так как эволюционный переход к многоклеточности не был одномоментным событием, микроРНК, видимо, появлялись одновременно с морфологическим усложнением и разрастанием остальных систем регуляции — протеинкиназ, мембранных рецепторов, транскрипционных факторов. В общем, открытие микроРНК — это прежде всего про устройство самой основы живого мира. Про то, как и благодаря чему он становился многоклеточным.
Продолжаются нескончаемые попытки как-то использовать микроРНК в медицинском ключе. Есть исследования по их связи с патогенезом различных заболеваний и применению в качестве биомаркеров, но пока больших прорывов в этой области не было. С использованием микроРНК в лечении заболеваний и разработке лекарств все еще сложнее, о чем в своем комментарии газете «Троицкий вариант» напоминает д. б. н., биоинформатик Михаил Гельфанд:
«Все стали спрашивать: насколько открытие микроРНК применимо в медицине, на практике? Я ненавижу этот вопрос. Прежде всего это открытие — очень хорошая, очень красивая биология. Мы знаем, что есть медицинские состояния, связанные с нарушениями в работе микроРНК. Но, скажем, мишенью для лекарств они быть не могут, потому что обычно микроРНК регулирует работу большого количества генов. И если вы начнете что-то специально с ней делать, вы сразу очень много на что повлияете. С медицинской точки зрения это не очень хорошо. Но для понимания того, как работает клетка, открытие микроРНК очень существенно. А мы знаем из жизненного опыта человечества, что любое хорошее понимание рано или поздно оказывается полезным».
Ценность открытия микроРНК — по крайней мере, на данный момент, — не в медицинском применении, а в возможности приблизиться к ответу на интригующий вопрос: как вообще возникли и существуют настолько сложные многоклеточные организмы, если во всех их клетках присутствует одинаковый набор генов? Но, тем не менее, на первый взгляд может показаться, что биологи отобрали Нобелевскую премию у медиков — что, конечно, не так. Просто во времена, когда Альфред Нобель учреждал свою премию, наука была совсем другой. «Конечно, наука молекулярная биология во времена Нобеля просто не существовала, поэтому выделить ее в отдельную номинацию он не мог», — комментирует Михаил Гельфанд. — «В микроскоп тогда, конечно, смотрели, но клеточной биологии в нашем понимании тоже еще не было. Молекулярная биология выросла в щели между физиологией, медициной и химией и постепенно их почти полностью заполонила». Так что фундаментально-биологическая Нобелевская премия просто отражает общую логику развития науки — как и вручение Нобелевских премий по физике и химии за работы в области нейросетей. Если XX век был веком физики и химии, то XXI век становится веком биологии и информатики. И решения Нобелевского комитета полностью следуют этой тенденции.
Георгий Куракин


Свежие комментарии